Grond is die mees fundamentele hulpbron vir die produsent, waarsonder voedsel en natuurlike vesel nie geproduseer kan word nie. In hierdie artikel in die reeks bespreek ons die vernaamste kleiminerale wat in grond voorkom.
Primêre minerale verweer chemies om die basiese elemente vir die vorming van sekondêre minerale te vorm. Omdat suurstof (O; 46,6%), silikon (Si; 27,7%) en aluminium (8,1%) die volopste elemente, op ‘n massagrondslag, in die aardkors is, kan mens aanvaar dat hierdie drie elemente ook die volopste in sekondêre minerale sal wees.
Kleiplaatjies
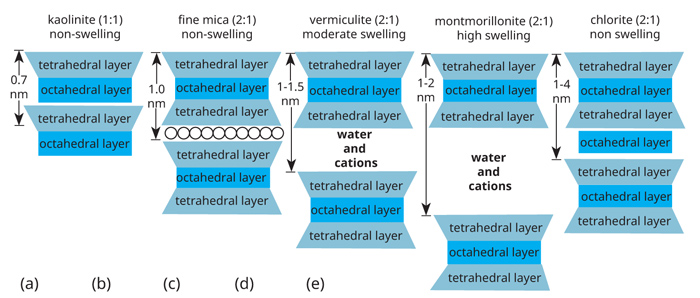
Die silikon-katioon word deur vier suurstofanione omring om ‘n vierkantige tetraëder te vorm. Die tetraëdrale kleiplaatjie vorm wanneer die tetraheders in die vorm van ‘n plaatjie rangskik. Die aluminium-katioon word deur ses hidroksied-anione (OH) omring om ‘n agtkantige oktaëder te vorm. Hierdie oktaëders rangskik hulself ook in ‘n plaatjie, wat dan die oktaëdrale plaat genoem word. Dit is kombinasies van hierdie tetraëdrale en oktaëdrale plate, wat die basiese boustene van die kleiminerale vorm. Omdat hierdie sekondêre minerale hoofsaaklik in die kleifraksie voorkom en weens die gelaagde geaardheid daarvan, word die terme sekondêre-, klei- of filosilikaat- (gelaagde) minerale gebruik, maar verwys na dieselfde dinge.
Kaoliniet-kleimineraal
Kaoliniet is die algemeenste kleimineraal in swak-gestruktuurde grond, wat die oorgrote meerderheid van die saaigrond in Suid-Afrika insluit. Kaoliniet ontstaan wanneer een Al-oktaëdrale laag en een Si-tetraëdrale laag saambind om ‘n 1:1 klei-mineraal te vorm (Figuur 1a en Figuur 2). Beperkte isomorfe substitusie [vervang deur dieselfde vorm] van Al3+ wat Si4+ in die tetraëdrale laag vervang, lei tot die ontstaan van ‘n negatiewe lading van tussen 10 en 15 cmolc kg-1 klei. [Een mol is gelykstaande aan 6,023 x 1023 (Avrogado se getal) deeltjies. Een centimol is dus een honderdste, of 6,023 x 1021 hiervan. Kaoliniet het dus 10 x 6,023 x 1021, of 6,023 x 1022 (60 230 000 000 000 000 000 000) negatiewe ladings per kg klei.] Hierdie lading moet deur katione gebalanseer word en gee aan klei die vermoë om katione te bind – die sogenaamde katioonuitruilkapasiteit (KUK). [Kaoliniet se lading is hoofsaaklik pH-afhanklik – meer hieroor in ‘n latere aflewering.]
Aangesien die een Al-OH oktaëdrale laag aanliggend tot die ander Si-O tetraëdrale laag voorkom, vind daar waterstofbinding tussen die twee onderskeie lagies plaas. Hierdie binding is relatief swak, maar is sterk genoeg om te verhoed dat water tussen die kleiplaatjies inbeweeg. Kaolinietminerale swel en krimp dus nie tydens benatting en uitdroging nie. Dit het dus stabiele fisiese eienskappe. Kaolinietkristalle is relatief groot en kom in die growwe kleifraksie voor. Kaoliniet is dus nie klewerig nie en is ook nie plasties nie. Kaoliniet kom aan die einde van die verweringsiklus voor, is relatief weerstandbiedend teen verdere verwering en verweer verder tot aluminiumoksiede. As gevolg van die lae KUK, hou dit nie baie katione vas nie en is dus ‘n swak voorsiener van basiese katione (kalium, kalsium, magnesium en natrium). Halloysiet is ook ‘n 1:1 kleimineraal, maar van mindere belang in grond.
Die 2:1-kleiminerale
Die 2:1-kleiminerale vorm wanneer een Al-oktaëdrale laag tussen twee Si-tetraëdrale lae vorm. Die belangrikste 2:1 kleiminerale is die fyn-mikas (Figuur 1b), vermikuliet (Figuur 1c) en montmorilloniet (Figuur 1d).
Die fyn-mikas
Die fyn-mikas en vermikuliet het isomorfe substitusie in die oktaërale (Mg2+ vervang Al3+) en tetraëdrale (Al3+ vervang Si4+) lae ondergaan. In die geval van die fyn-mikas word die negatiewe lading tot ‘n groot mate deur kalium (K+) gebalanseer wat knus tussen die onderskeie kleilagies pas. Die fynmikas kan dus nie tydens benatting en uitdroging swel en krimp nie. Die fyn-mikas is ʼn belangrike bron van K+ in die grond wanneer dit verweer. Die netto KUK van fyn-mika is 40 cmolc kg-1 klei.
Vermikuliet
Vermikuliet vorm wanneer die fyn-mika minerale die K+-katione in die tussenlaagruimtes deur verwering verloor. Vermikulietklei het dus ‘n hoë KUK van 140 cmolc kg-1 klei. Water en katione kan in die tussenlaagruimtes inbeweeg, maar omdat die klei die katione sterk bind, het die klei ‘n beperkte swel- en krimpvermoë tydens benatting en uitdroging. Die vernaamste eienskap van vermikuliet is dat dit K+ vir plante ontoeganklik in die tussenlaag ruimtes kan vaslê. Dit is dus ‘n vername vaslegger van sink- en kaliumkunsmis in die grond, hoewel hierdie K+ oor die lang termyn weer deur verwering vrygestel kan word.
Montmorilloniet
Montmorilloniet (Figuur 1d en Figuur 3) is ook ‘n 2:1 kleimineraal, maar het isomorfe substitusie van Mg2+ wat Al3+ vervang, net in die Al-oktaëdrale laag. Die lading is dus laer as in die geval van vermikuliet en is in die middel van die kleimineraal gekonsentreerd. Die katione word dus nie so sterk aangetrek nie en water kan dus maklik saam met katione in die tussenlaagruimtes in- en uitbeweeg. Dit veroorsaak dat montmorilloniet geweldig tydens benatting en uitdroging swel en krimp (byna dubbeld in grootte). Die montmorilloniet kleiminerale is klein en het ‘n hoë KUK van 100 cmolc kg-1 klei. Die ladings van 2:1 kleiminerale is hoofsaaklik permanent en word nie deur pH beïnvloed nie. Montmorilloniet kleiminerale is baie klein en derhalwe geweldig taai en plasties, het ‘n hoë affiniteit vir water en vir katione. Hierdie tipes klei is dus ‘n goeie voorsiener van plantvoedingstowwe, maar kan water sodanig vashou, dat dit vir plante ontoeganklik is. Aangesien die grond swel en krimp, veroorsaak dit groot krake in die droë toestand. Waterinfiltrasie sal dus vinnig wees wanneer die grond droog is, maar baie stadig wanneer dit nat is. Die taai geaardheid van die klei veroorsaak dat dit baie moeilik in die nat toestand bewerk word. In die droë toestand is dit gewoonlik te hard om te bewerk. Grond wat hoofsaaklik uit montmorilloniet bestaan, is problematies om te bewerk en te besproei, hoewel dit vrugbaar is. Hierdie grond staan in die volksmond as turfgrond bekend.

Chloriet
Chloriet (Figuur 1e) is ‘n spesiale 2:1 kleimineraal, waar ‘n Mg-oktaëdrale laag in die tussenlaagruimtes van die klei voorkom, wat die meeste van die negatiewe lading neutraliseer. Chloriet is dus in wese ‘n 2:1:1 kleimineraal. Isomorfe substitusie (Mg2+ vervang Al3+) in die Al-oktaëdrale laag gee aan chloriet ‘n KUK van 40 cmolc kg-1 klei. Die eienskappe van chloried is baie soos dié van die fyn mikas. Dit het ‘n beperkte KUK en matige hidrasie, swelling en plastisiteit. Die uitsondering is dat dit ‘n goeie bron van Mg2+ tydens verwering is.
Samevatting
Kleiminerale kan as die enjinkamer van die grond gesien word, omdat dit die klei is wat water en katioonplantvoedingstowwe vashou. Hoewel die onderskeie tipes klei uit dieselfde Al-oktaëdrale en Si-tetraëdrale lae bestaan, het dit wyd uiteenlopende eienskappe, weens variërende mates van isomorfe substitusie in hierdie lae. Kennis van die tipe kleimineraal in die grond kan die grondgebruiker dus in staat stel om die grond beter te bestuur.
Vir meer besonderhede skakel Martiens du Plessis by 072 285 5414 of stuur ‘n e-pos na: martiens@nwk.co.za of gesels met prof Cornie van Huyssteen by (051) 401-9247, of stuur ‘n e-pos na: vhuystc.sci@ufs.ac.za.
Verwysings
Die volgende bronne is ekstensief tydens die opstelling van hierdie artikelreeks gebruik:
- Brady, NC en Weil, RR. 2002. The nature and properties of soils. 13th ed. Prentice Hall: New Jersey.
- Van Huyssteen, CW. 2009. Grondekologie. Ongepubliseerde klasnotas vir GKD214. Universiteit van die Vrystaat, Bloemfontein.

















