Grond is die mees fundamentele hulpbron vir die produsent waarsonder voedsel en natuurlike vesel nie geproduseer kan word nie. Hierdie artikel vorm deel van ‘n reeks om hierdie hulpbron uit te lig. In hierdie uitgawe word grondsuurheid en die bestuur daarvan bespreek.
Inleiding
Die grond se suurheidsvlak (pH) is een van die belangrikste chemiese parameters in die meting van grond se algemene chemiese gesondheid. Dit beïnvloed plantegroei en die opname van ‘n verskeidenheid plantvoedingstowwe betekenisvol. Die handhawing van ‘n gunstige grond-pH, is vir die grondbenutter van groot belang en het ‘n wesenlike invloed op die volhoubare benutting van dié hulpbron.
Wat is pH?
‘n Belangrike eienskap van die grondoplossing is die grondreaksie – met ander woorde, of die grond suur, neutraal of alkalies is. Suur verwys na ‘n oormaat H+-ione teenoor OH–-ione en alkalies na ‘n oormaat OH–-ione in vergelyking met die H+-ione in die grondoplossing. By ‘n neutrale grondreaksie is daar gelyke hoeveelhede H+-ione en OH–-ione. Die grondreaksie word as pH gemeet. Dit is die negatiewe logaritme van die waterstof-ioonkonsentrasie [H+] uitgedruk in mol per liter (pH = -log [H+]) en dit wissel tussen 0 en 14. ‘n pH van 1 is sterk suur en ‘n pH van 14 is sterk alkalies, met ‘n pH van 7 as neutraal.
Byvoorbeeld: ‘n pH van 6 impliseer ‘n H+-ioonkonsentrasie van 10-6 mol liter-1 (0,000 001 mol/liter-1) en ‘n OH–-ioonkonsentrasie van 10-8 mol liter-1 (0,000 000 01 mol/liter-1) (die verskil tussen die pH-waarde en 14, is die OH–-konsentrasie). Daar is dus 10 x 10 = 100 keer meer H+-ione as OH–-ione in die grondoplossing en die grond is derhalwe suur.
By ‘n pH 7 is daar 10-7 mol liter-1 H+ en 10-7 mol liter-1 OH–-ione en die grond is neutraal. By ‘n pH 9 is daar minder H+-ione (10-9 mol/liter-1) as OH–-ione (10-5 mol/liter-1) en die grond is alkalies. Daar moet onthou word dat die verskil tussen pH-eenhede tienvoudige hoeveelhede aandui. ‘n Oplossing met ‘n pH = 4 het 1 000 keer meer H+-ione as ‘n oplossing met pH van 7.
Verwantskap van grondsuurheid met klimaat en topografie
Suur grond is algemeen in hoë reënvalstreke waar basiese katione uit die grond geloog is, met ‘n gepaardgaande toename in die H+– ioonkonsentrasie en dus ‘n afname in grondvrugbaarheid. Alkaliese grond word normaalweg met ‘n lae reënval en relatiewe akkumulasie van basiese katione in die grond geassosieer, dit wil sê beperkte loging. Diep sanderige grond op hoërliggende dele van die landskap en wat goed gedreineer, is meer geneig tot versuring as swakgedreineerde grond in laagliggende dele van die landskap waar die basiese katione akkumuleer.
Verandering in grond-pH
As gevolg van versuring, verhoog die geadsorbeerde waterstof en aluminium op die grond se uitruilkompleks. Alkalinisering is die verhoging in die geadsorbeerde basisse (kalium, kalsium, magnesium en natrium).
Grondversuring is die gevolg van:
- H+-ione wat in die grondoplossing vrygestel word deur die dissosiasie van organiese sure wat tydens die ontbinding van organiese materiaal vrygestel word.
- Anorganiese sure soos swawelsuur en salpetersuur kan ook saam met kunsmis of deur lugbesoedeling (suurreën) in die grond beland.
- Uitruilbare basiese katione soos Ca2+ en Mg2+ wat onder hoë reënval en intense loging uit die grond verwyder word, sodat H+– en Al3+-ione in die plek daarvan op die uitruilkompleks geadsorbeer word.
- Onder toestande van hoë grondsuurheid verweer die silikaatkleie en Al3+-ione word uit die oktahedrale lae van die klei vrygestel. Die Al3+-ione word in die grondoplossing na Al-hidroksied gehidroliseer, wat H+ ione vrystel en die grond derhalwe versuur.
| Al3+ | + H2O | → | Al(OH)2+ + H+ |
| Al(OH)2+ | + H2O | → | Al(OH)2+ + H+ |
| Al(OH)2+ | + H2O | → | Al(OH)3+ H+ |
| Al(OH)3 | + H2O | → | Al(OH)4– + H+ |
- Opgeloste soute van onder meer bemestingstowwe lewer basiese katione en sal in suur grond van die Al3+-ione op die kleikompleks uitruil, wat die grondoplossing se pH sal laat daal.
- Groeiende plantwortels skei koolstofdioksied (CO2) af, wat met water verbind om koolsuur te vorm, wat grondwater oplos om H+ vry te stel.
Omdat die H+-ioonkonsentrasie in die grondoplossing toeneem, word die ewewig tussen geadsorbeerde H+ op die kleikompleks en H+ in die grondoplossing versteur. Hierdie versteurde ewewig veroorsaak dat H+-ione van die basiese katione (Ca2+ en Mg2+) op die kleikompleks uitruil en dat H+-ione op die kleikompleks geadsorbeer word. Die basiese katione wat deur H+ verplaas is, beland in die grondoplossing en word deur loging of plantopname verwyder. Hierdie bose kringloop kan slegs verbreek word deur die konsentrasie van basiese katione in die grondoplossing deur byvoorbeeld bekalking te verhoog.
Neutralisering van grondsuurheid
Die algemeenste materiale wat gebruik word om grondversuring teen te werk is kalsiumoksied (CaO), kalsiumhidroksied [Ca(OH)2] en kalsitiese kalk [kalsiumkarbonaat (CaCO3)] of dolomitiese kalk [kalsium/magnesiumkarbonaat [CaMg(CO3)]. Wanneer kalk met die grond vermeng word, los dit op om die Ca2+– en/of Mg2+-ioonkonsentrasie van die grondoplossing te verhoog. Die Ca2+– en Mg2+-ione verplaas die H+-ione op die uitruilkompleks om H2O en CO2 te vorm.
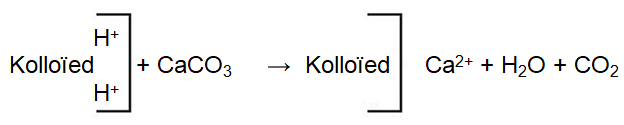
Alkalinisering vind plaas wanneer geadsorbeerde Al3+ en H+-ione deur basiese katione soos Ca2+, Mg2+, K+ en Na+ op die uitruilkompleks verplaas word. Gevolglik sal die H+-ioonkonsentrasie in die grondoplossing afneem en die OH–-konsentrasie sal toeneem, wat ‘n verhoging in pH tot gevolg het.
‘n Hoë basiese katioonkonsentrasie in die grondoplossing kan die gevolg wees van: (i) verwering van minerale; (ii) inwassing van sout vanaf hoërliggende gebiede; (iii) byvoeging van sout deur besproeiingswater; en (iv) beperkte loging weens ‘n lae reënval. Die hoeveelheid basisse of sure wat benodig word om een pH-eenheid verandering te bewerkstellig, sal tussen grond verskil. Die weerstand wat ‘grond teen ‘n verandering in pH bied, word die buffervermoë genoem. Grond wat goed gebuffer is, sal meer reagens benodig om die pH te verander as grond wat swak gebuffer is. ‘n Grond met ‘n goeie buffervermoë se pH sal onder natuurlike toestande konstant bly, terwyl die pH van swak gebufferde grond maklik sal versuur. ‘n Algemene reël is dat hoe hoër die grond se kleipersentasie en humusinhoud en derhalwe die katioonuitruilkapasiteit, hoe beter is dit gebuffer. Die ander kant van die muntstuk is dat humus-arme sandgrond ‘n lae buffervermoë het en makliker versuur, maar ook vinnig op bekalking sal reageer. ‘n Goeie buffervermoë en dus stabiele pH is ‘n bonus vir volgehoue gewasproduksie.
Die pH van grond kan verlaag word deur verbindings wat suurvormend of suurbevattend is, by die grond te voeg. Voorbeelde hiervan is organiese materiaal (veral dennenaalde), ferrosulfaat, swael en ammoniumsulfaat.
Die rol van pH in grond
Die meeste plante en grondorganismes funksioneer die beste by ‘n neutrale tot effens suur (pH(water) 6-7). By hierdie pH is die meeste plantvoedingstowwe redelik oplosbaar (Figuur 1) en kan dus deur plante en grondorganismes opgeneem word.
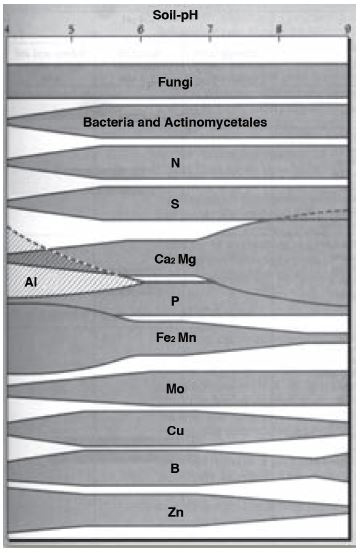 |
| Figuur 1: Die verwantskap tussen die beskikbaarheid van plantvoedingstowwe en pH (Brady & Weil, 2002). |
In alkaliese grond is verskeie mikro-elemente (Fe, Mn, Zn, Cu en B) ontoeganklik vir plantopname en sal tekorte in die plante, diere en mense wat dit benut, ontstaan. Mo, Cu en B is ontoeganklik in suurgrond en tekorte kan in plante en die benutters daarvan voorkom, terwyl Fe en Al in toksiese konsentrasies kan voorkom. Fosfor is in alkaliese en suurgrond minder toeganklik. Verskillende plantspesies verkies verskillende pH-grense. Mielies en koring verkies ‘n effens suur grond (pH(water) 6-6.5). Die meeste groentes verkies effens suur tot effens alkaliese grond (pH(water) 6-8) terwyl aartappels en sekere sierplante en sekere grasse, suurder grond verkies.
Samevatting
Omdat grond-pH die oplosbaarheid en dus toeganklikheid van plantvoedingstowwe bepaal, is dit die belangrikste grondchemiese faktor. Lae pH-vlakke is baie nadelig vir plantegroei. Voordat die grond se pH nie optimaal is nie, sal ander chemiese regstellings dus om dowe neute wees. Die neutralisering van grondsuurheid is dus die begin van chemiese bestuur van grond. Tydens die regstel van lae pH’s, word die Ca en Mg gewoonlik ook reggestel. Aluminium- en waterstofione word geneutraliseer.
Vir meer besonderhede skakel Martiens du Plessis by 072 285 5414 of stuur ‘n e-pos na: martiens@nwk.co.za of gesels met prof Cornie van Huyssteen by 051 401 9247, of stuur ‘n e-pos na: vhuystc.sci@ufs.ac.za.
Verwysings
- Bennie, ATP. 1990. Inleiding tot grondkunde. Klasnotas vir GKD218. Universiteit van die Vrystaat: Bloemfontein.
- Brady, NC and Weil, RR. 2002. The nature and properties of soils. 13th ed. Prentice Hall: New Jersey.
- Tisdale, SL, Nelson, WL, Beaton, JD & Havlin, JL. 1993. Soil Fertility and Fertilizers. Fifth edition. Macmillan Publishing Company: New York. USA.

















