
Direktoraat: Plantwetenskap, Wes-Kaapse
Departement van
Landbou, Elsenburg
 Dr Diane Mostert,
Dr Diane Mostert,Departement
Plantpatologie,
Universiteit Stellenbosch
 Huibrecht Schreuder,
Huibrecht Schreuder,Departement
Plantpatologie,
Universiteit Stellenbosch
Deel 1
Kanola is vir die eerste keer in 1992/1993 in Suid-Afrika aangeplant, toe ’n skrale 400 ton graan geproduseer is. Sedertdien het dit heelwat uitgebrei en ’n rekordoes van 166 956 ton graan is in 2020 op 74 120 ha geproduseer.
Vanjaar is ’n geskatte 95 000 ha kanola in die Wes-Kaap aangeplant, met ruimte vir verdere uitbreiding, beide in die Wes-Kaap (waar kanola amper uitsluitlik verbou word) asook na ander provinsies. Kanola word hoofsaaklik geproduseer vir die olie van hoë gehalte wat die saad bevat. Nadat die olie uit die saad gepers is, bevat die oorblywende oliekoek ’n hoë persentasie proteïen van goeie kwaliteit, wat dit ’n gewilde proteïenaanvulling by veevoer maak.
Kanola is ’n belangrike wisselbougewas in die Wes-Kaap, waar dit verbou word in afwisseling met gewasse soos koring, hawer, gars, lupiene en medics. Verskeie siektes beïnvloed kanola-opbrengste egter nadelig – met die belangrikste hiervan swartstam. ’n Reeks van drie artikels gaan hierdie siekte toelig, met die eerste wat fokus op agtergrondinligting, veroorsakende organismes en siekteverloop. Die tweede artikel sal handel oor die beheer van die siekte deur middel van kultivarweerstand, met die laaste wat sal fokus op die chemiese beheer van swartstam.
Patogene wat swartstam veroorsaak
Swartstam is die belangrikste siekte by kanola, beide plaaslik en in die res van die wêreld. Jaarlikse verliese in opbrengs beloop oor die algemeen tussen 10% en 20%, maar verliese van 90% is in 2003 in Australië aangemeld waar die patogeen suksesvol die weerstand van sekere kultivars oorkom het.
Hierdie siekte word deur twee swamspesies, naamlik Leptosphaeria maculans en Leptosphaeria biglobosa, veroorsaak. Infeksie met hierdie patogene lei tot simptome wat op alle dele van die plant kan voorkom. Dit veroorsaak letsels op blare en peule sowel as kankers op die stam en kroonarea van die plant. Leptosphaeria maculans is meer skadelik as L. biglobosa en is verantwoordelik vir die vorming van kankers aan die onderstam by die grondoppervlak (kroonkankers), wat die grootste impak op opbrengste het, sowel as hoërliggende stamkankers. Leptosphaeria biglobosa is minder skadelik en is meestal verantwoordelik vir hoërliggende stamkankers wat meer oppervlakkig van aard is.
Die verskil in vorming van kroon- en stamkankers tussen die twee Leptosphaeria-spesies is as gevolg van die vermoë van L. maculans om ’n gifstof, sirodesmin PL, te produseer wat bydra tot siekte-ontwikkeling. ’n Interessante eienskap van die swartstampatogene is dat dit slegs siekte kan veroorsaak in plante van die koolfamilie (Cruciferae). Dit kan dus nie gewasse soos koring, gars, medics of lupiene infekteer nie, maar wel ander koolgewasse asook koolagtige onkruid soos ramnas (Raphanus raphanistrum). Die Leptosphaeria-spesiekompleks wat swartstam veroorsaak, beskik oor ’n geweldige hoeveelheid rasse.
’n Patogeenras word beskryf as ’n groep binne die patogeenpopulasie wat slegs spesifieke planttipes of kultivars kan infekteer. In die geval van swartstam verskil rasse van die patogene in hul vermoë om spesifieke kanolakultivars te infekteer. Die identifikasie van Leptosphaeria-spesies en rasse wat swartstam in die Wes-Kaap veroorsaak, is ’n saak wat vanjaar aandag geniet.

Siekteverloop
Figuur 1 gee die siekteverloop van swartstam weer. Die patogene oorleef deur die somer op kanola-oesreste (stoppel) waar geslagtelike voortplanting dan plaasvind. Tydens geslagtelike voortplanting ruil individue van verskillende paringstipes (amper soos ’n mannetjie en wyfie by soogdiere) genetiese materiaal uit. Geslagtelike vrugliggame (pseudothecia), wat sigbaar is as swart kolletjies, ontwikkel dan op die stoppel (Foto 2). Binne hierdie pseudothecia ontwikkel geslagtelike spore (askospore). As gevolg van die geslagtelike voortplanting wat plaasgevind het, bevat die askospore nou DNS van beide ouers. Hierdie askospore is die belangrikste bron van infeksie en ontwikkeling van swartstam. Na blootstelling aan voldoende vog word askospore vanuit die pseudothecia uitgeskiet en deur lugstrome en wind versprei. Askospore word vrygestel solank as wat die stoppel op die land teenwoordig is, maar spoorvrystelling neem oor tyd af.
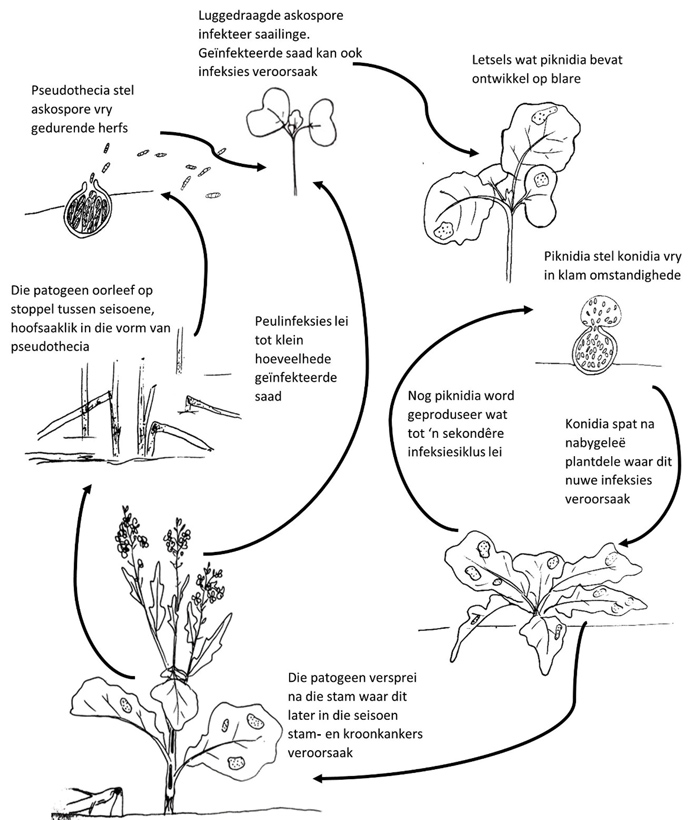
Bron: Huibrecht Schreuder

Die grootste voorkoms van askospore is binne die eerste 500 m van stoppel van die vorige jaar se kanola, maar askospore kan tot 8 km ver versprei. Wanneer dit op die blare van jong kanolasaailinge land, vind infeksie deur die huidmondjies of wonde plaas. Binne enkele dae word liggrys letsels op die blare sigbaar. Binne hierdie blaarletsels produseer die swam ongeslagtelike vrugliggame (piknidia), wat net soos pseudothecia as klein swart kolletjies sigbaar is (Foto 3 en Foto 4).


Piknidia bevat ongeslagtelike spore (konidia). Wanneer dit reën, vloei hierdie konidia uit die piknidia en word gespat na omliggende blare, peule of stamme, waar dit infekteer en sodoende sekondêre siektesiklusse veroorsaak. Die blaarletsels wat deur die twee patogene veroorsaak word, verskil merkbaar. Leptosphaeria maculans veroorsaak vaalgrys blaarletsels met baie piknidia. Vergeling (chlorose) is dikwels rondom die blaarletsels sigbaar en vind plaas as gevolg van die werking van die gifstof, sirodesmin PL, wat deur die patogeen afgeskei word. Leptosphaeria biglobosa vorm kleiner blaarletsels wat min, indien enige, piknidia bevat. Vanaf die blare groei die swam deur die blaarsteel tot binne die jong stam en bly daar sonder om simptome te veroorsaak. Dit staan bekend as die latente fase.
Later in die seisoen, gewoonlik vanaf die blomfase, begin die swam die weefsel in die stam en kroonarea doodmaak wat die kenmerkende stamkankers (Foto 5 en Foto 6) en kroonkankers (Foto 7 en Foto 8) veroorsaak. Vanaf die kroonarea kan die patogeen afwaarts na die wortels groei waar dit verrotting veroorsaak. Aan die einde van die seisoen, na afloop van die oes, oorleef die patogene weer op die stoppel wat op die land agterbly en die siklus word sodoende in die volgende seisoen voortgesit.




Foto: Dr Gert van Coller
Die geweldige hoeveelheid rasse waaroor die patogene beskik, die vermoë van die patogene om geslagtelik voort te plant, die effektiewe verspreiding van askospore deur middel van lugstrome, die vermoë van die patogene om verskillende plantdele te infekteer (insluitend saad) asook die sekondêre infeksiesiklusse wat kan plaasvind, is van die redes waarom swartstam steeds na al die jare so ’n groot probleem is.
Verskillende tipes infeksie
Vroeëseisoenblaarinfeksie
Blaarinfeksie wat vanaf die saailingfase tot min of meer die vyfblaarstadium plaasvind, is verantwoordelik vir die ontwikkeling van kroonkankers en stamkankers later in die seisoen (sien siekteverloop).
Peul- en saadinfeksie
Peule kan geïnfekteer word wanneer reën konidia vanaf blaarletsels tot op ontwikkelende peule laat spat (Foto 9) en ook wanneer askospore vanaf stoppel vrygestel word. Peulinfeksies word egter nie veroorsaak deur die verspreiding van swamgroei vanaf bestaande infeksies nie. Geïnfekteerde peule kan wel lei tot saadinfeksie en indien besmette saad teruggehou word om die volgende seisoen te plant, kan dit as bron van infeksie dien.

Foto: Piet Lombard
Besmette saad lei nie tot groot oesverliese nie, maar dit is bewys dat plante wat vanaf besmette saad ontwikkel later in die seisoen kroon- en stamkankers kan ontwikkel. Die saadgedraagde infeksie oorleef dan uiteindelik op die kanolastoppel aan die einde van die seisoen, waar dit deur paring deel van die bestaande swampopulasie word. Saadgedraagde infeksie, veral vanaf saad afkomstig vanaf ander lande, kan dus potensieel nuwe rasse van die patogene plaaslik laat vestig.
Bronne
- DAFF, 2016. Canola – production guidelines.
- Elliott, CE, Gardiner, DM, Thomas, G, Cozijnsen, A, Van de Wouw, A & Howlett, BJ. 2007. Production of the toxin sirodesmin PL by Leptosphaeria maculans during infection of Brassica napus. Molecular Plant Pathology, 8: 791 – 802.
- Fernando, WGD, Zhang, X & Amarasinghe, CC. 2016. Detection of Leptosphaeria maculans and Leptosphaeria biglobosa causing blackleg disease in canola from Canadian canola seed lots and dockage. Plants, 5: 12.
- Howlett, BJ. 2004. Current knowledge of the interaction between Brassica napus and Leptosphaeria maculans. Canadian Journal of Plant Pathology, 26: 245 – 252.
- Marcroft, SJ, Sosnowski, MR, Scott, ES, Ramsey, MD, Salisbury, PA & Howlett, BJ. 2005. Brassica napus plants infected after the third to fifth leaf growth stage in south-eastern Australia do not develop blackleg stem canker. European Journal of Plant Pathology, 112: 282 – 292.
- McCredden, J, Cowley, RB, Marcroft, SJ & Van de Wouw, AP. 2018. Changes in farming practices impact on spore release patterns of the blackleg pathogen, Leptosphaeria maculans. Crop and Pasture Science, 69: 1 – 8.
- Salam, MU, Khangura, RK, Diggle, AJ and Barbetti, MJ. 2003. Blackleg sporacle: A model for predicting onset of pseudothecia maturity and seasonal ascospore showers in relation to blackleg of kanola. Phytopathology, 93: 1073 – 1081.
- Sprague, SJ, Marcroft, SJ, Lindbeck, KD, Ware, AH, Khangura, RK & Van de Wouw, AP. 2018. Detection, prevalence and severity of upper canopy infection on mature Brassica napus plants caused by Leptosphaeria maculans in Australia. Crop and Pasture Science, 69: 65 – 78.
- Sprague, SJ, Watt, M, Kirkegaard, JA & Howlett, BJ. 2007. Pathways of infection of Brassica napus roots by Leptosphaeria maculans. New Phytologist, 176: 211 – 222.
- Stonard, JF, Latunde-Dada, AO, Huang, YJ, West, JS, Evans, N & Fitt, BDL. 2010. Geographic variation in severity of phoma stem canker and Leptosphaeria maculans / L. biglobosa populations on UK winter oilseed rape (Brassica napus). European Journal of Plant Pathology, 126: 97 – 109.
- Van de Wouw, AP, Elliott, VL, Ware, A, Lindbeck, K, Howlett, BJ & Marcroft, SJ. 2016. Infection of kanola pods by Leptosphaeria maculans and subsequent seed contamination. European Journal of Plant Pathology, 145: 687 – 695.
- West, JS, Balesdent, MH, Rouxel, T, Narcy, JP, Huang, YJ, Roux, J, Steed, JM, Fitt, BDL & Schmit, J. 2002. Colonization of winter oilseed rape tissues by A/Tox(+) and B/Tox(0) Leptosphaeria maculans (phoma stem canker) in France and England. Plant Pathology, 51: 311 – 321.
- West, JS, Kharbanda, PD, Barbetti, MJ & Fitt, BDL. 2001. Epidemiology and management of Leptosphaeria maculans (phoma stem canker) on oilseed rape in Australia, Canada and Europe. Plant Pathology, 50: 10 – 27.


























